Das von unserem Unternehmen entwickelte SARS-CoV-2-Testkit wurde am 22. Mai offiziell von der FDA EUA zertifiziertnd, angekündigt auf der offiziellen Website der FDA.Dies bedeutet, dass unser Produkt auf dem US-Markt „bestanden“ wurde und für groß angelegte Tests in CLIA Medical Certification Laboratories in den Vereinigten Staaten eingeführt werden kann.

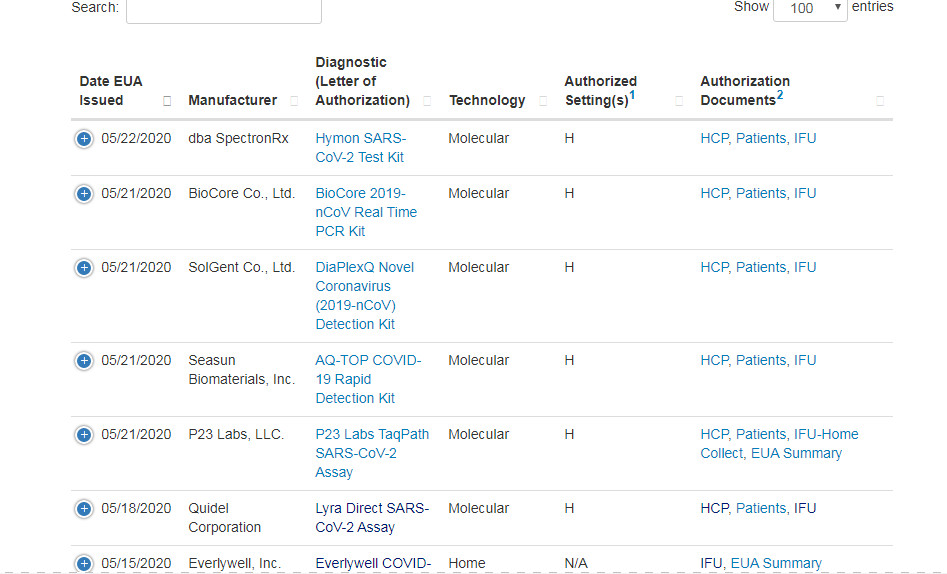
Wir sind das erste chinesische Unternehmen, das im vergangenen Monat die FDA-EUA-Zertifizierung erhalten hat, das fünfte Unternehmen in China, das die US-amerikanische FDA-EUA-Zertifizierung erhalten hat, und das einzige Unternehmen, das keine im Ausland verbundenen Unternehmen hat, die von der FDA zugelassen wurden.
„[Vor dem Ausbruch des neuartigen Coronavirus] hatte unser Unternehmen keine Geschäftsbeziehungen mit der SpectronRX Pharmaceutical Company aus den Vereinigten Staaten“, sagte CEO Dr. Tammy Tan.„Nach dem Ausbruch von COVID-19 in den Vereinigten Staaten nahm SpectronRX aktiv Kontakt zu uns auf, nachdem es relevante Informationen aus dem Internet und anderen Kanälen erhalten hatte, kontaktierte uns und bot an, mit uns zusammenzuarbeiten.Nach einigen Verhandlungen ermächtigten wir sie, unseren Hymon zu vertreten®SARS-CoV-2-Testkit, das von uns in Nordamerika entwickelt und produziert wurde.“
John Zehner, CEO von SpectronRX Pharmaceuticals, schrieb an unser Unternehmen: „Die COVID-19-Epidemie stellt das US-amerikanische Gesundheitssystem weiterhin auf die Probe und stellt es vor Herausforderungen.Wir brauchen vielfältige Maßnahmen zur Bekämpfung des Virus.Der Hymon®Das SARS-CoV-2-Testkit hat den Vorteil, dass es schnell, einfach und genau ist.Es kann in mehr als 7000 medizinisch zertifizierten CLIA-Labors in den Vereinigten Staaten für groß angelegte Tests eingesetzt werden.“
In Zukunft werden wir mit der SpectronRX Pharmaceutical Company zusammenarbeiten, um Patienten und Ärzten weiterhin einen einzigartigen Mehrwert auf dem Gebiet der Diagnose und Behandlung schwerer Krankheiten zu bieten.
Zeitpunkt der Veröffentlichung: 29. Mai 2020

